Magneziu
Magneziul este elementul chimic din tabelul periodic al elementelor care face parte din grupa a doua si care are simbolul Mg și numărul atomic 12. Magneziul este al optulea element și al treilea metal după aluminiu și fier ca abundență în scoarța solidă terestră, formând aproximativ 2% din masa acesteia. Magneziul este al treilea ca și componență în sărurile dizolvate în apa mării.
Istoric
Denumirea este de origine greacă, Magnesia fiind numele unei regiuni din Tessalia. Englezul Joseph Black a identificat pentru prima oară magneziul ca element în anul 1755, Sir Humphry Davy a obținut pentru prima dată magneziu pur în 1808, dintr-un amestec de oxid de magneziu și HgO, iar A.A.B. Bussy l-a preparat într-o formă legată in 1831. Magneziul este un metal alcalino-pământos și de aceea nu se întâlnește decât combinat cu alte elemente. Se găsește în zăcăminte mari de magnezit (carbonat de magneziu), dolomit și alte minerale de exemplu talc.
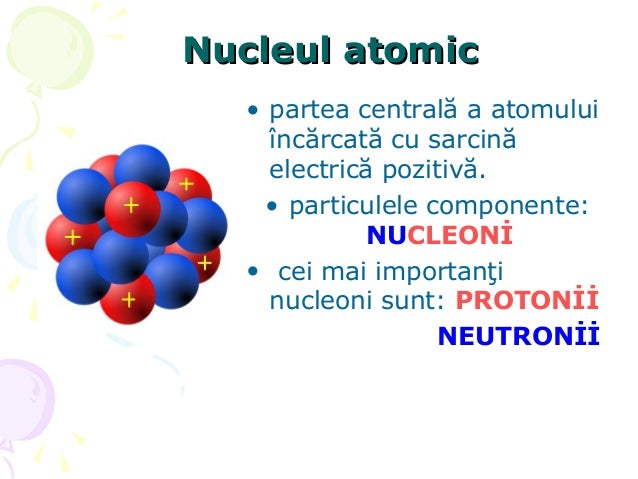
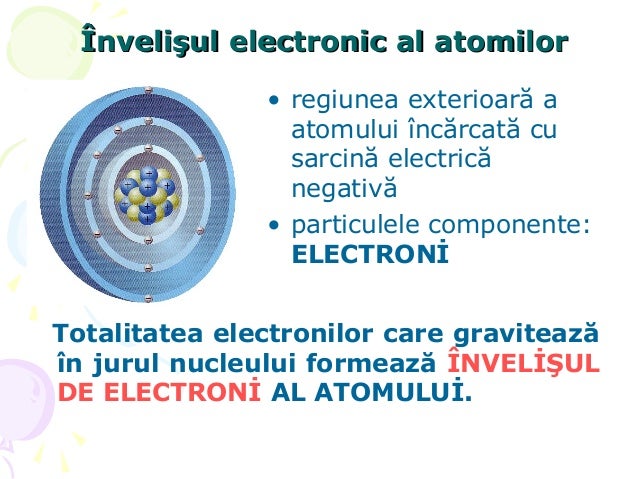
Structură atomică
- K=2e L=8e M=2e=> grupa a II-a perioada a 3-a
- K=2e L=8e M=2e=> grupa a II-a perioada a 3-a
Răspândire in natura
Verdețurile, ca de exemplu spanacul, furnizează magneziu pentru că molecula de clorofilă conține acest metal. Nucile, semințele și unele cereale sunt o bună sursă de magneziu. Deși magneziul este prezent în multe alimente, se întâlnește în general în cantități mici. Conform părerii multor nutriționiști, necesarul zilnic de magneziu nu poate fi asimilat dintr-un singur fel de mâncare. Mâncând o mare varietate de mâncăruri, incluzând cinci feluri de fructe și legume zilnic și multe cereale, se poate asigura doza adecvată de magneziu.Cantitatea de magneziu conținută în alimentele prelucrate este în general mică. Apa poate fi o sursă de magneziu, dar cantitatea diferă în funcție de calitatea apei. Iată câteva aliente și cantitatea de magneziu aferentă:
- spanac (1/2 cana)= 80 mg
- unt de arahide (2 lingurițe) = 50 mg
- lapte degresat (1 cana) = 40 mg
Producere
1) Preparare în laborator
2) Producere la scară industrială
Deși magneziul se găsește în peste 60 de minerale, numai dolomitul, magnezitul, brucitul, carnalitul, talcul și olivina au importanță economică. În Statele Unite, acest metal se obține în principal prin electroliza clorurii de magneziu din apa de mare și lacuri sărate.
Pana in 1995, Statele Unite erau cel mai mare producător de magneziu, furnizând 45% din producția mondială. Astăzi, China a preluat supremația, cu 60% din producția mondială. China folosește o metodă complet diferită de obținere a magneziului și anume dezoxidarea silicotermică.
Proprietăți
Proprietăți fizice
Magneziul este un metal foarte rezistent, de culoare alb-argintie, foarte ușor (cu o treime mai ușor decât aluminiul) și care devine ușor mat în contact cu aerul. În soluție, formează ioni de Mg++. Este ușor de aprins când este sub formă de fâșii subțiri. Odată aprins, arde cu o flacără albă, foarte luminoasă și este greu de stins, fiind capabil să ardă la interacțiunea cu azotul și dioxidul de carbon.
Proprietăți chimice
Magneziul se combină și cu clorul formând clorura de magneziu, conform reacției:
Magneziul reacționează și cu sulful,bromul,iodul formând compușii respectivi.
Utilizare
Compuși ai magneziului, în principal oxidul de magneziu, sunt utilizați ca material refractar pentru cuptoarele din industria siderurgică - la producerea fontei și oțelului, industria metalelor neferoase, a sticlei și a cimentului. Oxidul de magneziu și alți compuși sunt de asemenea utilizați în agricultură (ca fertilizatori), chimie și industria construcțiilor. Aliajul magneziu-aluminiu este utilizat în principal la conservarea băuturilor. Aliajele magneziului sunt de asemenea utilizate ca și componente ale structurii automobilelor. O altă utilizare o reprezintă îndepărtarea sulfurilor de pe fier și oțeluri.
Alte utilizări:
- Magneziul, ca și aluminiul, este rezistent și ușor, deci este folosit la construcția autovehiculelor de mare volum.
- Combinat în aliaje, este esențial în construcția avioanelor și rachetelor.
- Aliat cu aluminiul, îi îmbunătățește acestuia caracteristicile mecanice, de prelucrare și de sudare.
- Hidroxidul său este folosit în "laptele de magneziu", clorura și sulfatul de magneziu în săruri Epsom, iar citrații săi în medicină.
- Pudra de carbonat de magneziu este folosită de sportivi – gimnaste, halterofili.
- Stearatul de magneziu este o pudră albă, cu proprietăți de ungere. În industria farmaceutică este folosit în procesul de fabricare a tabletelor.
- Este folosit de asemenea în pirotehnie și la fabricarea bombelor incendiare.
- Mai este folosit si la echipamentele pentru blițuri fotografice.
Rolul elementului în biologie
Magneziul este important atât în dezvoltarea animalelor cât și a plantelor. Clorofila constă în porfirine bazate pe magneziu. Necesarul zilnic de magneziu al unui adult este de 300-400 mg în funcție de sex, greutate și înălțime. O dozare inadecvată a magneziului cauzează deseori spasme musculare și este asociată cu boli cardiovasculare, diabet, hipertensiune și osteoporoză. Deficiența acută este rară și nu este niciodată datorată unei insuficiențe din alimentație ci urmare a unor boli specifice care sunt în general rare.Doza maximă admisa pentru suplimentul de magneziu este de 350 mg/zi. Cel mai comun simptom generat de excesul de magneziu este diareea. Copiilor nu trebuie să li se dea supliment de magneziu.
Măsuri de protecție chimică
Magneziul și aliajele lui în forma lor pură sunt foarte inflamabile când sunt topite sau sub formă de pulbere. Magneziul reacționează exotermic la contactul cu aerul și apa și trebuie mânuit cu grijă. Lumina albă strălucitoare (care include ultraviolete), produsă la arderea magneziului, poate dăuna ochilor, de aceea trebuie folosiți ochelari de protecție. Apa nu trebuie folosită la stingerea magneziului aprins, deoarece alimentează focul în loc să-l stingă, conform reacției:
Mg(s) + 2 H2O(l) → Mg(OH)2(aq) + H2(g)
Extinctoarele cu dioxid de carbon, de asemenea nu trebuie folosite, deoarece magneziul arde în dioxid de carbon (formând oxid de magneziu MgO și carbon). Extinctoarele folosite trebuie să fie unele de clasa D, uscate sau focul se poate acoperi pur și simplu cu nisip.
https://youtu.be/sL_4Zi7Y0wg (Efectele nebănuite ale magneziului)
Bibliografie
- D. Marian, Metale de înaltă puritate, Editura Tehnică, 1988
- https://ro.wikipedia.org/wiki/Magneziu