Atomul este cea mai mică unitate constitutivă a materiei comune care are proprietățile unui element chimic.
- atomos (lb.greaca)=,,ce nu poate fi taiat''
Totalitatea atomilor de acelasi tip alcatuiesc un element chimic.Se cunosc 112 elemente chimice:
- 90 de elemente chimice(11 gaze, 2 lichide , 77 solide)
- 22 de elemente chimice artificiale.
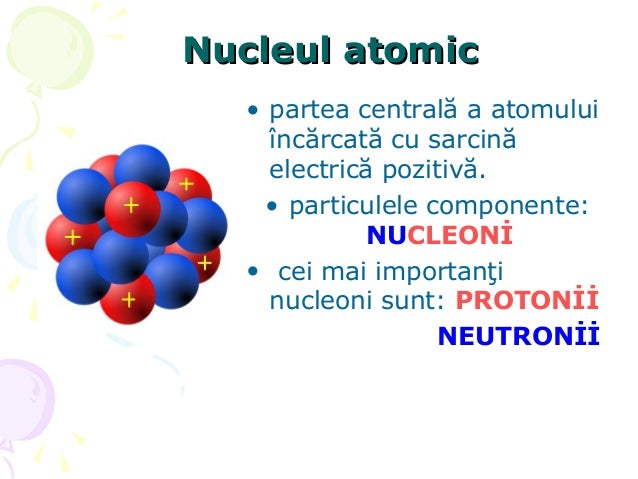
Fiecare atom este format dintr-un nucleu și din unul sau mai mulți electroni legați de nucleu. Nucleul este format din unul sau mai mulți protoni și, de obicei, dintr-un număr similar de neutroni. Protonii și neutronii se numesc nucleoni. Peste 99,94% din masa unui atom este concentrată în nucleu. Protonii au sarcina electrica pozitivă, electronii au sarcină electrică negativă, iar neutronii nu au sarcină electrică. Dacă numărul de protoni este egal cu cel de electroni, atunci atomul este neutru din punct de vedere electric. Dacă un atom are mai mulți sau mai puțini electroni decât protoni, atunci acesta are o sarcină totală negativă, respectiv pozitivă, și se numește ion.


Ocuparea straturilor electronice cu electroni
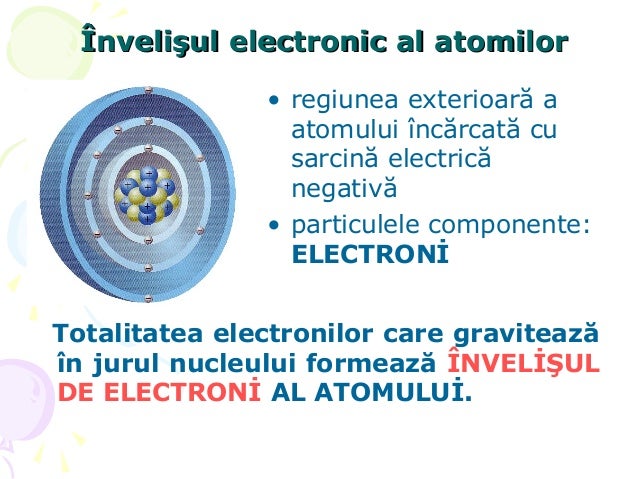
Repartizarea electronilor unui atom pe straturile electronice reprezinta structura electronica a atomului.Ocuparea straturilor electronice cu electroni se face dupa anumite reguli:
- Electronii din jurul nucleului tind sa se aranjeze pe straturile cu energii cat mai joase (ocuparea straturilor se face de la nucleu spre exterior)
- Numarul maxim de electroni care pot exista este dat de relatia: Nmax.=2*n^2 unde ,,n''-numarul stratului electronic :n=1;2;3;4...
- Intr-un atom pe ultimil strat electronic (K, L, M, N, O, P, sau Q)nu pot exista mai mult de 8 electroni.